शासन व्यवस्था
भारत में बाल चिकित्सा दवाओं का विनियमन
- 27 Oct 2025
- 153 min read
यह एडिटोरियल “Respect the health rights of India’s children” पर आधारित है, जो दि हिंदू में 25/10/2025 को प्रकाशित हुआ था। यह लेख तर्क देता है कि भारत को बालकों के स्वास्थ्य अधिकारों की रक्षा करने और मध्य प्रदेश में दूषित कफ सिरप से 25 बालकों की मृत्यु जैसी त्रासदियों को रोकने के लिये अपने बाल औषधियों से संबंधित नियामक, नैतिक और अनुसंधान ढाँचों को तत्काल सुदृढ़ करना चाहिये।
प्रिलिम्स के लिये: केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO), भारत की औषधि सतर्कता कार्यक्रम (PvPI), राष्ट्रीय औषधि मूल्य निर्धारण प्राधिकरण (NPPA), औषधि और प्रसाधन सामग्री अधिनियम, 1940, गर्भधारण पूर्व और प्रसवपूर्व निदान तकनीक अधिनियम, 1994, संयुक्त राष्ट्र बाल अधिकार अभिसमय, प्रधानमंत्री भारतीय जनऔषधि परियोजना (PMBJP), फार्मास्युटिकल उद्योग सुदृढ़ीकरण योजना (SPI योजना)
मेन्स के लिये: भारत में बाल औषधियों को संचालित करने वाला संवैधानिक और नीतिगत ढाँचा, भारत में बाल औषधियों के विनियमन में प्रमुख चुनौतियाँ, भारत में औषधि क्षेत्र को प्रोत्साहित करने हेतु सरकारी पहलें
हाल ही में मध्य प्रदेश में दूषित कफ सिरप के कारण 25 बालकों की दुखद मृत्यु ने पूरे देश को गंभीर रूप से चिंतित कर दिया है, जिससे भारत की बाल स्वास्थ्य सेवाओं और औषधि सुरक्षा प्रणाली में मौजूद गहन कमियाँ उजागर हुई हैं। देश की कुल जनसंख्या में लगभग 40% बालक शामिल हैं, ऐसे में उन्हें सुरक्षित और प्रभावी औषधियों की उपलब्धता सुनिश्चित करना अत्यंत आवश्यक है। अप्रभावी नियामक निगरानी, बाल-विशिष्ट अनुसंधान की कमी और अपर्याप्त औषधि सतर्कता प्रणाली (Pharmacovigilance) यह दर्शाती है कि भारत के सबसे नवीन और संवेदनशील नागरिकों की सुरक्षा के लिये ठोस और प्रभावी नीतियों की तत्काल आवश्यकता है।
भारत में बाल चिकित्सा औषधियों के लिये संवैधानिक और नीतिगत ढाँचा क्या है?
- संवैधानिक प्रावधान:
- अनुच्छेद 21: जीवन के अधिकार की गारंटी देता है, जिसे न्यायालयों ने स्वास्थ्य के अधिकार के रूप में भी व्याख्यायित किया है। यह राज्य को बालकों के लिये सुरक्षित स्वास्थ्य सेवाएँ और औषधियाँ उपलब्ध कराने की ज़िम्मेदारी निर्दिष्ट करता है।
- अनुच्छेद 39(f): (राज्य के नीति निदेशक तत्त्व) राज्य को यह सुनिश्चित करने का निर्देश देता है कि बालकों को स्वस्थ रूप से विकसित होने के अवसर मिलें और उन्हें शोषण एवं उपेक्षा से संरक्षित रखा जाए।
- अनुच्छेद 47: राज्य को पोषण स्तर और जीवन स्तर को ऊँचा उठाने का निर्देश देता है, जिससे बाल स्वास्थ्य को सार्वजनिक स्वास्थ्य की जिम्मेदारियों से जोड़ा गया है।
- नीतिगत और कानूनी उपाय:
- औषधि और प्रसाधन सामग्री अधिनियम, 1940 एवं नियम, 1945: यह अधिनियम औषधि निर्माण, गुणवत्ता और नैदानिक परीक्षणों को विनियमित करने वाला प्रमुख विधिक ढाँचा है। इसमें बाल परीक्षण (अनुसूची Y) हेतु नैतिक प्रोटोकॉल भी शामिल हैं।
- राष्ट्रीय बाल नीति, 2013: इस नीति में जीवन, स्वास्थ्य, पोषण, शिक्षा, विकास, संरक्षण और सहभागिता को प्रत्येक बालक का निर्विवाद अधिकार माना गया है।
- राष्ट्रीय स्वास्थ्य नीति, 2017: इस नीति का उद्देश्य सभी आयु वर्गों के लिये उच्चतम स्तर का स्वास्थ्य और कल्याण सुनिश्चित करना है, जो निवारक और प्रोत्साहक स्वास्थ्य सेवा तथा गुणवत्तापूर्ण स्वास्थ्य सेवाओं तक सार्वभौमिक पहुँच के माध्यम से प्राप्त किया जाएगा।
- बालकों से संबंधित जैव-चिकित्सीय अनुसंधान के लिये राष्ट्रीय नैतिक दिशा-निर्देश (ICMR, 2017 अद्यतन): यह दिशा-निर्देश नाबालिगों पर किये जाने वाले अनुसंधानों हेतु मानक निर्धारित करते हैं, जिनमें अभिभावक की सहमति, न्यूनतम जोखिम तथा नैतिक पर्यवेक्षण शामिल हैं।
- किशोर न्याय अधिनियम, 2015: यह भारत में एक विधिक ढाँचा है, जिसका उद्देश्य उन बालकों की सुरक्षा और देखभाल सुनिश्चित करना है जो या तो कानून से संघर्ष की स्थिति में हैं या दुरुपयोग, उपेक्षा या परित्याग के कारण संरक्षण एवं देखभाल की आवश्यकता में हैं।
- संयुक्त राष्ट्र बाल अधिकार अभिसमय (UNCRC), 1992: भारत द्वारा इस अभिसमय के अनुमोदन से राज्य पर यह दायित्व आता है कि वह बालकों के लिये उच्चतम स्वास्थ्य मानक और सुरक्षित चिकित्सीय उपचार सुनिश्चित करे।
- संस्थागत और नियामक ढाँचा:
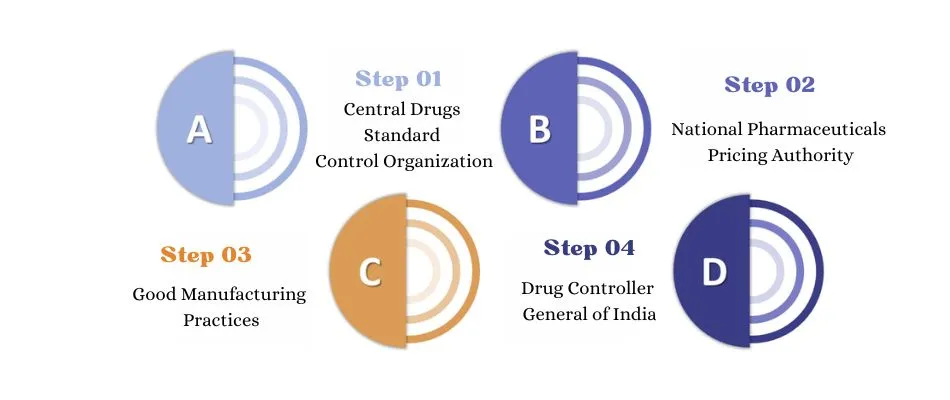
- केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO): यह भारत का राष्ट्रीय औषधि नियामक प्राधिकरण है, जो दवाओं की गुणवत्ता, सुरक्षा और अनुमोदन की निगरानी के लिये ज़िम्मेदार है।
- भारतीय औषधकोश आयोग (Indian Pharmacopoeia Commission- IPC): यह भारत सरकार के स्वास्थ्य और परिवार कल्याण मंत्रालय के अधीन एक स्वायत्त संस्था है।
- यह आयोग भारतीय औषध संहिता (Indian Pharmacopoeia- IP) के निर्माण और अद्यतन के लिये जिम्मेदार है, जो भारत में औषधियों के गुणवत्ता मानकों का आधिकारिक संकलन है।
- भारत का औषधि सतर्कता कार्यक्रम (Pharmacovigilance Programme of India- PvPI): यह पूरे देश में औषधियों के प्रतिकूल प्रभावों (Adverse Drug Reactions- ADR) की निगरानी करने और औषधि सुरक्षा संकेतों की पहचान करने हेतु ज़िम्मेदार है।
- सामान्य औषधि नियंत्रण निरीक्षकालय (General Drugs Control Inspectorate- GDCI): यह CDSCO और राज्य प्राधिकरणों को सहयोग प्रदान करता है, ताकि अनुपालन जाँच, जोखिम-आधारित निरीक्षण तथा औषधि निर्माण इकाइयों और खुदरा विक्रेताओं से नमूना परीक्षण प्रभावी रूप से किया जा सके।
- यह निकाय CDSCO द्वारा चिह्नित निम्न-स्तरीय या नकली दवाओं की पहचान और रिपोर्टिंग में महत्त्वपूर्ण भूमिका निभाता है तथा कानूनी प्रवर्तन कार्रवाइयों को सुगम बनाता है।
- राष्ट्रीय औषधि मूल्य निर्धारण प्राधिकरण (NPPA): यह प्राधिकरण आवश्यक दवाओं के मूल्य को विनियमित करता है, मूल्य सीमा (Price Cap) लागू करता है और फार्मा कंपनियों में लागत अनुपालन की निगरानी करता है ताकि दवाएँ जनसामान्य के लिये सुलभ और किफायती बनी रहें।
- यह CDSCO के साथ मिलकर कार्य करता है ताकि आवश्यक बाल औषधि संरचनाएँ (Paediatric Formulations) सुरक्षित घटनाओं के बाद भी, जो उत्पाद की उपलब्धता को प्रभावित करती हैं, सुलभ और किफायती बनी रहें।
भारत में बाल औषधियों के विनियमन में प्रमुख चुनौतियाँ क्या हैं?
- असंगत और अप्रभावी नियामक निगरानी: भारत में केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO) और विभिन्न राज्य औषधि नियंत्रकों के बीच नियामक विभाजन के कारण प्रवर्तन में गंभीर कमियाँ बनी हुई हैं।
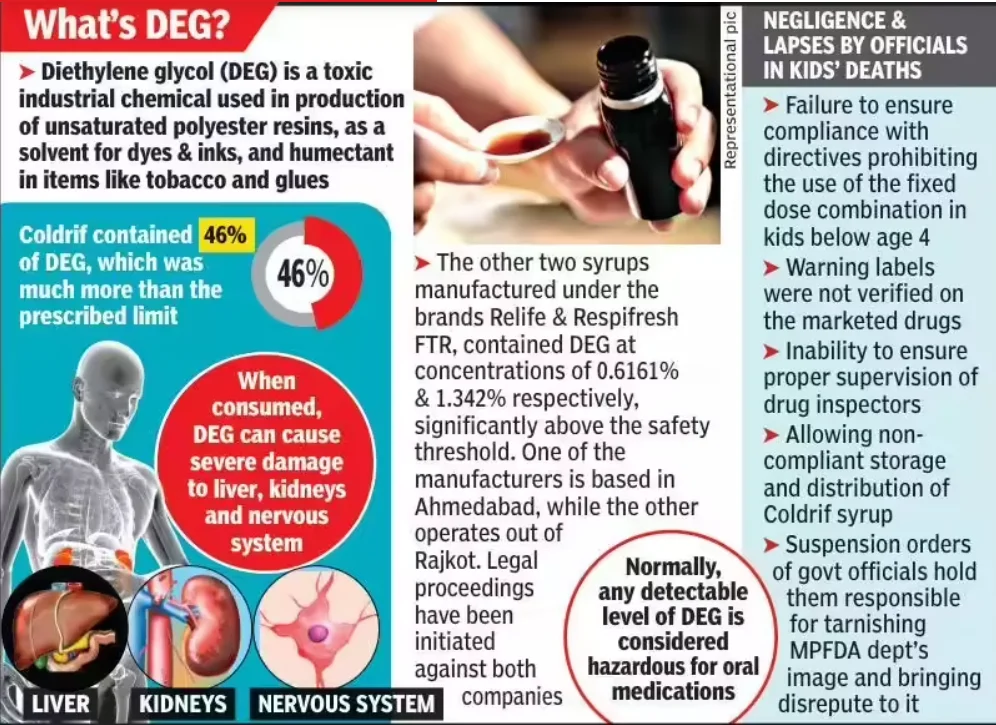
- वर्ष 2025 में मध्य प्रदेश कफ सिरप संकट के दौरान नियामकों ने स्रेसन फार्मास्युटिकल्स (ColdriF निर्माता) में 364 नियम उल्लंघन पाए गए, जिसमें डायथिलीन ग्लाइकॉल (DEG) एक औद्योगिक सॉल्वेंट में पाया जाने वाला विषाक्त पदार्थ शामिल था।
- हालाँकि CDSCO ने निर्यात परीक्षण नियमों को सख्त किया है परंतु घरेलू बिक्री के लिये ऐसा कोई अनिवार्य प्रावधान नहीं है, जिससे लाखों भारतीय बच्चे असुरक्षित दवाओं के प्रति संवेदनशील बने हुए हैं।
- इसके अतिरिक्त, CDSCO के अधीन प्रस्तावित केंद्रीकृत रियल-टाइम औषधि निगरानी पोर्टल 2023 से लंबित है, जिसके कारण प्रयोगशालाओं और प्रवर्तन इकाइयों के बीच डेटा-साझाकरण सीमित है।
- समर्पित बाल औषधि सतर्कता का अभाव: वर्तमान कानून (गर्भाधान पूर्व और प्रसव पूर्व नैदानिक तकनीक अधिनियम, राष्ट्रीय बाल नीति 2013) बालकों के लिये औषधि सुरक्षा को विशेष रूप से संबोधित नहीं करते; संविधान का अनुच्छेद 39(f) राज्य को बालकों के स्वास्थ्य और विकास की रक्षा का निर्देश देता है किंतु यह औषधि सतर्कता में पर्याप्त रूप से लागू नहीं किया गया है।
- औषधियों का परीक्षण प्रायः केवल वयस्कों पर किया जाता है और बालकों के लिये खुराक वयस्कों के आँकड़ों से अनुमानित की जाती है, जिसके परिणामस्वरूप बालकों के लिये असुरक्षित और गैर-उपयुक्त उपचार सामने आते हैं।
- बालकों के लिये विशिष्ट खुराक दिशा-निर्देश उपलब्ध नहीं हैं, जिससे त्रुटियाँ और प्रतिकूल औषधि प्रतिक्रियाएँ (ADR) बढ़ जाती हैं।
- इसके विपरीत, अमेरिका का पीडियाट्रिक रिसर्च इक्विटी एक्ट विपणन स्वीकृति से पहले बाल-विशिष्ट अध्ययन को अनिवार्य बनाता है, जिससे नैतिक परीक्षण और खुराक निर्धारण (Dosage Calibration) सुनिश्चित होता है, ऐसा प्रावधान भारत में अनुपस्थित है।
- भ्रष्टाचार, लापरवाही और अप्रभावी गुणवत्ता नियंत्रण: विषाक्त संदूषण से बार-बार होने वाली घटनाएँ यह दर्शाती हैं कि समस्या संयोगवश नहीं, बल्कि प्रणालीगत (systemic) है।
- वर्ष 2022–2023 में गाम्बिया में लगभग 70 और उज़्बेकिस्तान में 18 बच्चों की मृत्यु भारत में निर्मित कफ सिरपों से संबंधित पाई गई।
- शुद्धिकरण और परीक्षण पर लागत में कटौती, अप्रभावी निरीक्षण तथा भ्रष्ट लाइसेंसिंग प्रथाएँ ऐसे संदूषण चक्रों को बनाए रखती हैं।
- अधिकांश राज्य औषधि नियंत्रण प्रयोगशालाओं में ग्लाइकॉल संदूषण की पहचान के लिये आवश्यक गैस क्रोमैटोग्राफी या मास स्पेक्ट्रोमीटर जैसे उन्नत उपकरणों का अभाव है।
- ओवर-द-काउंटर (OTC) दवाओं का दुरुपयोग और अभिभावकीय अनभिज्ञता: अध्ययनों से पता चलता है कि भारत में अधिकांश शिशु औषधियाँ बिना प्रिस्क्रिप्शन के खरीदी जाती हैं, विशेष रूप से नगरीय झुग्गी क्षेत्रों और टियर-2 शहरों में।
- देखभाल करने वाले लोग (केयरगिवर्स) अक्सर लक्षण बने रहने पर खुराक दोगुनी (डबल डोज़) कर देते हैं, उन्हें पता नहीं होता कि सिरप का कंसंट्रेशन अलग-अलग ब्रांड में अलग-अलग होता है।
- बालकों की एंटीबायोटिक्स और कफ सिरप की बिना रोक-टोक बिक्री से ड्रग रेजिस्टेंस तथा गलत उपयोग बढ़ता है और बालकों के लिये सुरक्षित तरीके से दवा देने के बारे में फार्मासिस्टों की शिक्षा की कमी से यह समस्या और भी बढ़ जाती है।
- व्यापक बाल औषधि नीति का अभाव: WHO और राष्ट्रीय बाल अधिकार संरक्षण आयोग (NCPCR) की बार-बार की अनुशंसाओं के बावजूद भारत में अब तक कोई बाल औषधि विनियामक प्राधिकरण या बाल-विशिष्ट औषधि संहिता (Child-Specific Medicines Code) नहीं है।
- WHO की चेतावनियों के बाद वर्ष 2023 में केवल निर्यात किये जाने वाले सिरप के लिये ही DEG और EG जैसे विषाक्त पदार्थों की जाँच अनिवार्य की गई, घरेलू बिक्री के लिये नहीं।
- WHO अधिकारियों ने इस “दो-स्तरीय सुरक्षा व्यवस्था” की आलोचना की, जिसमें वैश्विक बाज़ार को भारतीय बच्चों की तुलना में बेहतर सुरक्षा मिलती है। उन्होंने इसे समान स्वास्थ्य अधिकारों का उल्लंघन बताया।
- जम्मू (2019) में बालकों की मृत्यु से लेकर मध्य प्रदेश (2025) संकट तक बार-बार होने वाली त्रासदियों के बावजूद, बाल औषधि सुरक्षा पर केंद्रित कोई संसदीय श्वेत-पत्र अब तक प्रस्तुत नहीं किया गया है।
- परिवारों को शायद ही कभी मुआवज़ा या पारदर्शी रिपोर्टिंग मिलती है; अधिकांश मामलों को “उत्पादन दोष” (Manufacturing Defects) बताकर बंद कर दिया जाता है, बिना किसी प्रणालीगत सुधार के।
- WHO की चेतावनियों के बाद वर्ष 2023 में केवल निर्यात किये जाने वाले सिरप के लिये ही DEG और EG जैसे विषाक्त पदार्थों की जाँच अनिवार्य की गई, घरेलू बिक्री के लिये नहीं।
भारत में फार्मास्युटिकल सेक्टर को बढ़ावा देने के लिये सरकार की क्या पहलें हैं?
- उत्पादन आधारित प्रोत्साहन (PLI) योजनाएँ: औषधि विभाग (Department of Pharmaceuticals) तीन प्रमुख PLI योजनाओं का संचालन करता है।
- फार्मास्यूटिकल्स के लिये PLI योजना: फरवरी 2021 में स्वीकृत, इस योजना के तहत वित्तीय प्रावधान ₹15,000 करोड़ (वित्त वर्ष 2022-23 से 2027-28 तक) निर्धारित किया गया है।
- यह योजना 55 चयनित आवेदकों को उच्च मूल्य वाले औषधि उत्पादों जैसे पेटेंटेड/नॉन-पेटेंटेड दवाएँ, बायोफार्मास्यूटिकल्स और जटिल जेनेरिक दवाओं के निर्माण के लिये प्रोत्साहित करती है।
- KSM, DI और API के लिये PLI योजना: मार्च 2020 में शुरू की गई इस योजना के तहत ₹6,940 करोड़ का प्रावधान (वित्त वर्ष 2020-21 से 2029-30 तक) किया गया है।
- इसका उद्देश्य 41 महत्त्वपूर्ण की स्टार्टिंग मटीरियल्स (KSM), ड्रग इंटरमीडिएट्स (DI) और एक्टिव फार्मास्युटिकल इंग्रेडिएंट्स (API) के घरेलू निर्माण को प्रोत्साहित करना है, ताकि अत्यधिक आयात निर्भरता को कम किया जा सके।
- चिकित्सा उपकरणों के लिये PLI योजना: वित्त वर्ष 2020-21 से 2027-28 तक ₹3,420 करोड़ के प्रावधान के साथ स्थापित की गई।
- यह भारत में निर्मित चयनित चिकित्सा उपकरणों की क्रमिक (इन्क्रिमेंटल) बिक्री पर 5% की वित्तीय प्रोत्साहन राशि प्रदान करती है, जिससे रेडियोलॉजी, इमेजिंग, कैंसर देखभाल और इम्प्लांट जैसे क्षेत्रों में अत्याधुनिक विनिर्माण को बढ़ावा मिलता है।
- फार्मास्यूटिकल्स के लिये PLI योजना: फरवरी 2021 में स्वीकृत, इस योजना के तहत वित्तीय प्रावधान ₹15,000 करोड़ (वित्त वर्ष 2022-23 से 2027-28 तक) निर्धारित किया गया है।
- बल्क ड्रग पार्कों को प्रोत्साहन: मार्च 2020 में स्वीकृत इस योजना का उद्देश्य विश्वस्तरीय अवसंरचना के साथ बल्क ड्रग पार्कों के विकास को प्रोत्साहित करना है, ताकि विनिर्माण लागत को कम किया जा सके और आत्मनिर्भरता को सुदृढ़ किया जा सके।
- गुजरात, हिमाचल प्रदेश और आंध्र प्रदेश में पार्कों को स्वीकृति दी गई है, जिनके लिये प्रत्येक पार्क को अधिकतम ₹1,000 करोड़ या परियोजना लागत का 70% (पूर्वोत्तर और पर्वतीय राज्यों के लिये 90%) तक की वित्तीय सहायता प्रदान की जाएगी। इस योजना का कुल प्रावधान ₹3,000 करोड़ है।
- प्रधानमंत्री भारतीय जनऔषधि परियोजना (PMBJP): इस योजना का उद्देश्य देशभर में जन औषधि केंद्रों के नेटवर्क के माध्यम से सस्ती दरों पर गुणवत्तापूर्ण जेनेरिक दवाइयाँ उपलब्ध कराना है।
- फार्मास्युटिकल उद्योग सुदृढ़ीकरण योजना (SPI Scheme): यह एक केंद्रीय क्षेत्र योजना है, जिसके लिये वित्त वर्ष 2021-22 से 2025-26 तक ₹500 करोड़ का प्रावधान किया गया है। इस योजना का उद्देश्य औषधि उद्योग की अवसंरचना, क्षमता निर्माण और नवाचार को प्रोत्साहित करना है।
- विदेशी प्रत्यक्ष निवेश (FDI) सुविधा: वित्त वर्ष 2024-25 (अप्रैल-दिसंबर 2024) के दौरान औषधि और चिकित्सा उपकरण क्षेत्रों में ₹11,888 करोड़ का FDI प्रवाह दर्ज किया गया।
- इस अवधि में ₹7,246.40 करोड़ मूल्य के 13 ब्राउनफील्ड FDI प्रस्तावों को स्वीकृति दी गई, जिससे तकनीकी प्रगति और वैश्विक प्रतिस्पर्द्धात्मकता को बढ़ावा मिला।
- आत्मनिर्भर भारत और मेक इन इंडिया मिशन: ये मिशन स्वदेशी विनिर्माण पर बल देते हैं, ताकि आत्मनिर्भरता प्राप्त की जा सके, आयात निर्भरता कम हो और भारत को औषधि निर्यात के वैश्विक केंद्र के रूप में स्थापित किया जा सके।
भारत में बाल-औषधियों के विनियामक ढाँचे को सुदृढ़ करने हेतु कौन-से कदम उठाए जाने चाहिये?
- राष्ट्रीय बाल-औषधि सुरक्षा एवं नैतिकता प्राधिकरण (NPSEA) की स्थापना: भारत को केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO) के अधीन NPSEA की स्थापना करनी चाहिये, जो बाल-औषधियों के लाइसेंसिंग, सूत्रीकरण (फॉर्म्युलेशन) अनुमोदन और नैतिक परीक्षणों की निगरानी करेगा।
- उदाहरण के लिये, यूरोपीय औषधि एजेंसी (EMA) एक पेडियाट्रिक समिति (PDCO) संचालित करती है, जो यह सुनिश्चित करती है कि सभी नई दवाओं को अनुमोदन से पहले बाल-उपयोग के लिये परीक्षण किया जाए।
- मशेलकर समिति की रिपोर्ट (2003) ने भारत की औषधि नियामक अवसंरचना की अपर्याप्तता को रेखांकित किया था और एक सुदृढ़, “विश्व-स्तरीय” औषधि नियंत्रण प्राधिकरण की स्थापना हेतु अधिक बजटीय आवंटन की अनुशंसा की थी।
- पूर्ण असहिष्णुता व्यवस्था और आपराधिक जवाबदेही: ड्रग्स एंड कॉस्मेटिक्स अधिनियम (1940) में संशोधन करके निम्न-गुणवत्ता वाली बाल-औषधियों के कारण हुई मृत्यु के मामलों को गैर-ज़मानती अपराध की श्रेणी में शामिल किया जाना चाहिये।
- अनिवार्य रिकॉल (वापसी) और प्रकटीकरण नीति लागू की जानी चाहिये, जिसके अंतर्गत सार्वजनिक स्वास्थ्य पोर्टलों पर वास्तविक समय (रियल-टाइम) अद्यतन उपलब्ध कराया जाए।
- संयुक्त राज्य अमेरिका के ड्रग क्वालिटी एंड सिक्योरिटी अधिनियम (DQSA), 2013 ने प्रवर्तनीय दंड और राष्ट्रीय रिकॉल प्रणाली की स्थापना की थी, भारत को इसी प्रकार के प्रावधान अपनाने चाहिये।
- साथ ही, नियत अंतराल पर बिना सूचना के निरीक्षण, डिजिटल ऑडिट और प्रयोगशाला कर्मचारियों के लिये व्हिसलब्लोअर संरक्षण की व्यवस्था भी की जानी चाहिये।
- राष्ट्रीय बाल-नैदानिक अनुसंधान एवं डाटा पारिस्थितिकी तंत्र की स्थापना: बाल नैदानिक परीक्षणों (Paediatric Clinical Trials- PCT-India) के लिये एक राष्ट्रीय रजिस्ट्री स्थापित की जानी चाहिये, जो औषधियों के फार्माकोडायनेमिक (प्रभावगत) और सुरक्षा संबंधी डाटा का संग्रह एवं विश्लेषण करना।
- नैतिक, भारत-विशिष्ट बाल-औषधि अनुसंधान एवं विकास (R&D) करने वाली दवा कंपनियों को वित्तीय प्रोत्साहन प्रदान करना।
- संयुक्त राज्य अमेरिका के बेस्ट फार्मास्युटिकल्स फॉर चिल्ड्रन एक्ट (BPCA) और पेडियाट्रिक रिसर्च इक्विटी एक्ट (PREA) बालकों पर अध्ययन की गई दवाओं के लिये संघीय वित्तपोषण और डेटा तक पहुँच प्रदान करते हैं।
- फार्मासिस्ट और केयरगिवर शिक्षा को संस्थागत बनाना: फार्मेसी काउंसिल ऑफ इंडिया के तहत फार्मासिस्टों के लिये बाल चिकित्सा वितरण प्रोटोकॉल में अनिवार्य प्रमाणन लागू करना।
- स्कूलों और आँगनवाड़ी केंद्रों के माध्यम से खुराक और लेबल रीडिंग पर देशव्यापी देखभालकर्त्ता (Caregiver) जागरूकता अभियान चलाना।
- विश्व स्वास्थ्य संगठन (WHO) के “मेक मेडिसिन्स चाइल्ड साइज” अभियान (वर्ष 2007) ने 40 से अधिक विकासशील देशों में औषधि संबंधी जागरूकता और फार्मासिस्ट प्रशिक्षण में सुधार किया।
- अनिवार्य बैच परीक्षण और आपूर्ति शृंखला ट्रेसेबिलिटी: अनुमोदन एजेंसियों को सभी बाल चिकित्सा फार्मूलों के लिये रिलीज से पहले अनिवार्य बहु-प्रयोगशाला आविषविज्ञान परीक्षण (CDSCO + NABL-मान्यता प्राप्त प्रयोगशालाएँ) सुनिश्चित करना चाहिये।
- सरकार को उत्पाद की उत्पत्ति से लेकर अपरिष्कृत रासायनिक चरण तक का पता लगाने के लिये QR-आधारित बैच ट्रैकिंग को लागू करना चाहिये।
- अमेरिकी FDA की सुरक्षित आयात चेतावनी प्रणाली डिजिटलीकृत परीक्षण प्रमाणन का उपयोग करती है, जो भारत की औषधि ट्रेसिबिलिटी के लिये अनुकूल है।
- अंतर्राष्ट्रीय बेंचमार्किंग और नैतिक पारदर्शिता: भारत की वैश्विक औषधि भूमिका के लिये विश्व स्वास्थ्य संगठन के मानकों और UNCRC (अनुच्छेद 24) के अनुरूप पारदर्शिता की आवश्यकता है।
- भारत को बाल चिकित्सा औषधि विकास के लिये OECD फार्माकोविजिलेंस मानकों और ICH E11(R1) दिशानिर्देशों जैसे अंतर्राष्ट्रीय औषधि सुरक्षा ढाँचे के प्रति प्रतिबद्ध होना चाहिये।
- सुधारात्मक कदमों के लिये निरीक्षण रिपोर्ट, आविषविज्ञान परिणाम, तथा जनता का विश्वास पुनः स्थापित करने के लिये रिकॉल सूचना का सार्वजनिक प्रकटीकरण आवश्यक है।
- यूरोपीय औषधि एजेंसी (EMA) सभी अनुपालन निरीक्षण परिणामों को सार्वजनिक रूप से सूचीबद्ध करती है; भारत भी इसी प्रकार की कार्यप्रणाली अपना सकता है।
- संस्थागत खुलापन जवाबदेही को बढ़ावा देगा, लापरवाही को रोकेगा और वैश्विक फार्मा केंद्र के रूप में भारत की प्रतिष्ठा को मज़बूत करेगा।
निष्कर्ष:
जैसा कि विश्व स्वास्थ्य संगठन ने ज़ोर देकर कहा है, "प्रत्येक बच्चे को शुरू से ही सुरक्षित और गुणवत्तापूर्ण स्वास्थ्य सेवा मिलनी चाहिये।" इस दृष्टिकोण को साकार करने के लिये, भारत के औषधि प्रशासन को नैतिक विनियमन, कठोर परीक्षण, प्रभावी संघीय समन्वय और पारदर्शी जवाबदेही को प्राथमिकता देनी होगी। विश्व स्वास्थ्य संगठन के अनुरूप गुणवत्ता मानकों को अपनाकर, औषधि सतर्कता प्रणालियों को मज़बूत करके और बाल चिकित्सा-केंद्रित औषधि नीतियों को डिज़ाइन करके, भारत एक प्रतिक्रियावादी ढाँचे से बच्चों के स्वास्थ्य अधिकारों के एक सक्रिय संरक्षक के रूप में विकसित हो सकता है।
|
दृष्टि मेंस प्रश्न: प्रश्न. गरिमा से लेकर सुरक्षा तक, बाल स्वास्थ्य सतत् विकास के केंद्र में है। आलोचनात्मक मूल्यांकन कीजिये कि क्या वर्तमान नीतिगत ढाँचे बाल चिकित्सा औषधि सुरक्षा को सार्वजनिक स्वास्थ्य प्राथमिकता के रूप में पर्याप्त रूप से संबोधित करते हैं। |
अक्सर पूछे जाने वाले प्रश्न (FAQs)
1. भारत में बच्चों के स्वास्थ्य की सुरक्षा के लिये कौन से संवैधानिक प्रावधान हैं?
अनुच्छेद 21, 39(f) और 47 सामूहिक रूप से राज्य को स्वास्थ्य, पोषण और वंचना से सुरक्षा के अधिकार को सुनिश्चित करने का आदेश देते हैं, जो बाल चिकित्सा स्वास्थ्य देखभाल के लिये संवैधानिक आधार बनाते हैं।
2. भारत में औषधि की गुणवत्ता और फार्माकोविजिलेंस को कौन सी संस्थाएँ नियंत्रित करती हैं?
CDSCO अनुमोदन और सुरक्षा की देखरेख करता है; IPC इंडियन फार्माकोपिया के माध्यम से गुणवत्ता मानक निर्धारित करता है; और PvPI देश भर में प्रतिकूल औषधि प्रतिक्रियाओं (ADR) की निगरानी करता है।
3. भारत में बाल चिकित्सा औषधि सुरक्षा में कौन सी प्रमुख चुनौतियाँ बाधा डालती हैं?
कमज़ोर विनियामक समन्वय, बच्चों के लिये विशिष्ट फार्माकोविजिलेंस का अभाव, वयस्क-आधारित खुराक, निम्नस्तरीय प्रयोगशाला अवसंरचना, और OTC दुरुपयोग बच्चों के लिये औषधि सुरक्षा से समझौता करते हैं।
4. फार्मास्युटिकल क्षेत्र को मज़बूत करने के लिये सरकार की क्या पहल है?
फार्मास्यूटिकल्स के लिये PLI, बल्क ड्रग पार्क, PMBJP, SPI योजना और FDI सुविधा जैसी योजनाएँ घरेलू विनिर्माण, आत्मनिर्भरता और किफायती पहुँच को बढ़ावा देती हैं।
5. भारत में बाल चिकित्सा औषधि सुरक्षा सुनिश्चित करने के लिये क्या सुधार प्रस्तावित हैं?
राष्ट्रीय बाल औषधि सुरक्षा प्राधिकरण की स्थापना, शून्य-सहनशीलता उत्तरदायित्व, अनिवार्य बैच परीक्षण, बाल अनुसंधान एवं विकास हेतु प्रोत्साहन, तथा विश्व स्वास्थ्य संगठन के अनुरूप पारदर्शिता प्रमुख उपाय हैं।
UPSC सिविल सेवा परीक्षा विगत वर्ष के प्रश्न (PYQ)
मेन्स
प्रश्न. 'निश्चित मात्रा औषध संयोगों' (FDC) से आप क्या समझते हैं? उनके गुण-दोषों की विवेचना कीजिये। (2013)
प्रश्न. क्या ऐन्टीबायोटिकों का अति-उपयोग और डॉक्टरी नुस्खे के बिना मुक्त उपलब्धता, भारत में औषधि-प्रतिरोधी रोगों के अविर्भाव के अंशदाता हो सकते हैं? अनुवीक्षण और नियंत्रण की क्या क्रियाविधियाँ उपलब्ध हैं? इस संबंध में विभिन्न मुद्दों पर समालोचनापूर्वक चर्चा कीजिये। (2014)