वैश्विक मानक GMP पर DCGI के निर्देश | 13 Nov 2025
प्रिलिम्स के लिये: भारतीय औषधि महानियंत्रक, विश्व स्वास्थ्य संगठन, केंद्रीय औषधि मानक नियंत्रण संगठन, राष्ट्रीय औषधि मूल्य निर्धारण प्राधिकरण
मेन्स के लिये: औषधि एवं प्रसाधन सामग्री अधिनियम के अंतर्गत औषधि विनियमन सुधार, सार्वजनिक स्वास्थ्य एवं औषधि सुरक्षा, विश्व की फार्मेसी के रूप में भारत की भूमिका
चर्चा में क्यों?
भारत के औषधि महानियंत्रक (DCGI) ने राज्य औषधि नियंत्रकों को निर्देश दिया है कि वे जनवरी, 2026 तक औषधि और प्रसाधन सामग्री अधिनियम, 1940 तथा नियम, 1945 की अनुसूची M के अंतर्गत संशोधित गुड मैन्युफैक्चरिंग प्रैक्टिसेज़ (GMP) को लागू करें, ताकि भारत के औषधि निर्माण मानकों को वैश्विक मानकों के अनुरूप बनाया जा सके।
- यह कदम भारत और विदेशों में संदूषित कफ सिरप के कारण कई बच्चों की मृत्यु की घटनाओं के बाद बढ़ी हुई निगरानी के बीच उठाया गया है।
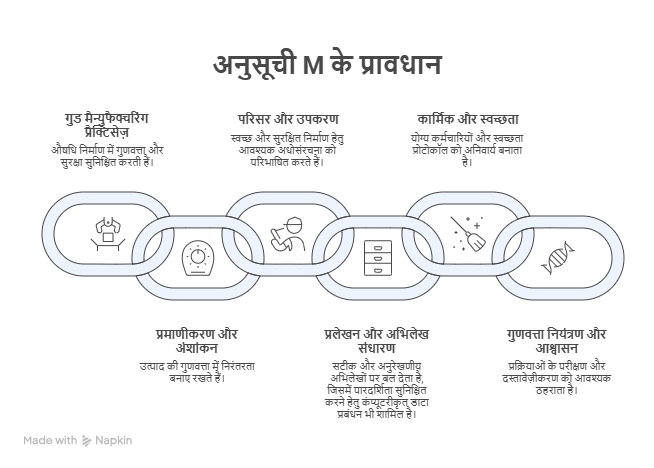
औषधि और प्रसाधन सामग्री अधिनियम, 1940 की अनुसूची M क्या है?
- परिचय: औषधि और प्रसाधन सामग्री अधिनियम, 1940 (तथा संबंधित औषधि और प्रसाधन सामग्री नियम, 1945) के अंतर्गत अनुसूची M एक वैधानिक ढाँचा है जो यह सुनिश्चित करता है कि देश में निर्मित सभी दवाएँ घरेलू उपयोग एवं निर्यात दोनों के लिये सुरक्षित, प्रभावी तथा समान गुणवत्ता वाली हों।
- वर्ष 2023 में केंद्र सरकार ने अनुसूची M की आवश्यकताओं में संशोधन करते हुए ‘GMP’ को विस्तारित कर “औषधीय उत्पादों हेतु गुड मैन्युफैक्चरिंग प्रैक्टिसेज़ तथा संयंत्र एवं उपकरणों की आवश्यकताएँ” नाम दिया, जिससे भारत के औषधि निर्माण मानक विश्व स्वास्थ्य संगठन (WHO) के GMP मानकों के अनुरूप हो सकें।
- अनुसूची M के प्रमुख प्रावधान:
भारत के फार्मास्युटिकल उद्योग की वर्तमान स्थिति क्या है?
- भारत विश्व की फार्मेसी के रूप में: भारत मात्रा के हिसाब से विश्व का तीसरा सबसे बड़ा औषधि उत्पादक देश है तथा मूल्य के हिसाब से 14वाँ सबसे बड़ा उत्पादक देश है।
- यह जेनेरिक दवाओं का सबसे बड़ा आपूर्तिकर्त्ता भी है, जो वैश्विक निर्यात का लगभग 20% है तथा विश्व भर में सस्ते टीकों का एक प्रमुख स्रोत है, जो इसे ‘विश्व की फार्मेसी’ के रूप में दर्जा देता है।
- भारत का फार्मा क्षेत्र यूनिसेफ के 55-60% टीकों की आपूर्ति करता है, जो WHO की DPT (डिप्थीरिया, काली खाँसी और टेटनस) वैक्सीन की 99% मांग को पूरा करता है, BCG (बैसिलस कैलमेट-गुएरिन एक वैक्सीन है जो मुख्य रूप से तपेदिक (TB) के खिलाफ इस्तेमाल किया जाता है) के लिये 52% और खसरे के लिये 45% मांग को पूरा करता है।
- अफ्रीका से लेकर अमेरिका तक, भारतीय वैक्सीन ने लाखों लोगों का जीवन बचाया है।
- भारत का जैव प्रौद्योगिकी क्षेत्र: भारत का जैव प्रौद्योगिकी उद्योग वर्ष 2014 में 10 बिलियन अमेरिकी डॉलर से बढ़कर वर्ष 2024 में 130 बिलियन अमेरिकी डॉलर से अधिक हो गया (13 गुना वृद्धि)। वर्ष 2030 तक इसके 300 बिलियन अमेरिकी डॉलर तक पहुँचने का अनुमान है।
- आर्थिक संभावना: दवा और फार्मा निर्यात 15.07 अरब अमेरिकी डॉलर (2013-14) से बढ़कर वर्ष 2023-24 में 27.85 अरब अमेरिकी डॉलर हो गया है। अमेरिका, बेल्जियम, दक्षिण अफ्रीका, ब्रिटेन और ब्राज़ील शीर्ष पाँच निर्यात गंतव्य हैं।
- भारतीय फार्मास्युटिकल उद्योग के वर्ष 2030 तक 10% से अधिक CAGR की दर से बढ़कर 130 बिलियन अमेरिकी डॉलर तक पहुँचने का अनुमान है।
- भारत चिकित्सा पर्यटन का एक वैश्विक केंद्र बन गया है, जो स्वास्थ्य सेवा क्षेत्र में बड़े सुधारों के कारण किफायती, उच्च गुणवत्ता वाले उपचार की सुविधा प्रदान कर रहा है।
भारत के फार्मास्युटिकल उद्योग के समक्ष क्या चुनौतियाँ हैं?
- गुणवत्ता नियंत्रण और अनुपालन संबंधी समस्याएँ: भारत ने कई निम्न-स्तरीय और दूषित दवाओं की घटनाएँ देखी हैं, जिनमें भारत तथा विदेशों में कफ सिरप से जुड़ी दुखद घटनाएँ भी शामिल हैं।
- कई लघु और मध्यम औषधि निर्माता GMP का पूर्णतः अनुपालन करने में संघर्ष करते हैं।
- कई देशों ने दवाओं में संदूषण एवं सुरक्षा संबंधी समस्याओं को लेकर चिंता जताई है और बार-बार गुणवत्ता में हुई चूक तथा विश्व स्वास्थ्य संगठन (WHO) की चेतावनियों ने भारत की एक विश्वसनीय औषधि निर्माता के रूप में साख को प्रभावित किया है।
- संयुक्त राज्य अमेरिका के फूड एंड ड्रग एडमिनिस्ट्रेशन (FDA) जैसी वैश्विक प्रमाणन एजेंसियों के मानकों का अनुपालन अब अधिक महँगा हो गया है, जिससे छोटे निर्यातकों पर वित्तीय दबाव बढ़ गया है।
- नियामक कमज़ोरियाँ: भारत की औषधि नियामक प्रणाली अभी भी खंडित है, जो केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO) और राज्य स्तरीय औषधि प्राधिकरणों के बीच विभाजित है।
- इस ओवरलैप के कारण प्रवर्तन में असंगति और अनुमोदन प्रक्रियाओं में देरी होती है।
- वैश्विक मानकों के अनुरूप बनने के लिये संशोधित अनुसूची M (2023) लागू किये जाने के बावजूद, इसके कार्यान्वयन की गति धीमी रही है, जिससे विभिन्न क्षेत्रों के मानकों में असमानता बनी हुई है।
- आयातित कच्चे माल पर निर्भरता: भारत अपनी लगभग 70% सक्रिय दवा सामग्री (Active Pharmaceutical Ingredients - API) का आयात मुख्य रूप से चीन से करता है, जो आपूर्ति शृंखला की सुरक्षा और मूल्य स्थिरता के लिये एक गंभीर जोखिम उत्पन्न करता है।
- कोविड-19 महामारी ने भारत की आयात पर अधिक निर्भरता को उजागर किया, जिसके परिणामस्वरूप घरेलू औषधि उत्पादन प्रभावित हुआ।
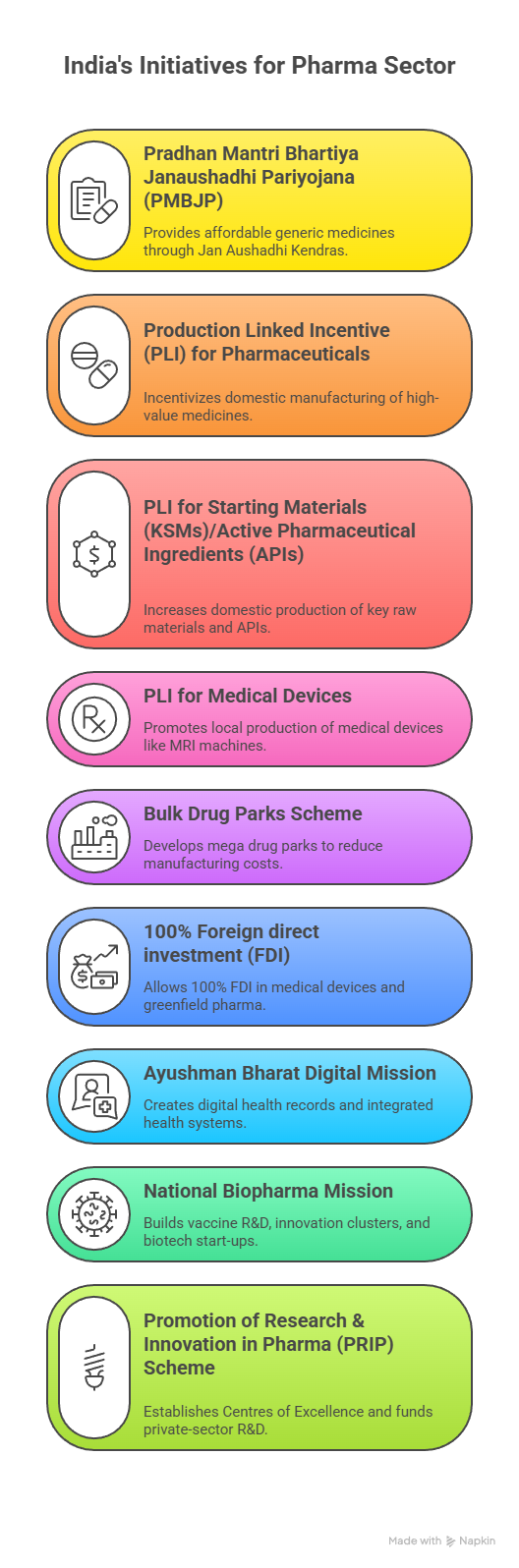
- यद्यपि सरकार ने स्थानीय विनिर्माण को बढ़ावा देने हेतु थोक दवाओं के लिये PLI योजना शुरू की, लेकिन प्रगति सीमित ही रही।
- मूल्य नियंत्रण और कम लाभांश: राष्ट्रीय औषधि मूल्य निर्धारण प्राधिकरण (NPPA) द्वारा लगाए गए सख्त मूल्य सीमा नियंत्रण आवश्यक दवाओं को जनता के लिये सुलभ बनाए रखते हैं, लेकिन इससे कंपनियों के लाभांश में कमी आती है।
- इससे अनुसंधान एवं विकास (R&D) या प्रौद्योगिकी उन्नयन में निवेश की संभावना बहुत कम रह जाती है। परिणामस्वरूप कंपनियाँ अक्सर नवाचार और गुणवत्ता सुधार की तुलना में लागत दक्षता को प्राथमिकता देती हैं।
- कमज़ोर अनुसंधान एवं विकास: अधिकांश भारतीय दवा कंपनियाँ नई दवाओं या अणुओं के विकास के बजाय जेनेरिक उत्पादन पर ध्यान केंद्रित करती हैं।
- शैक्षणिक संस्थानों, उद्योग एवं सरकार के बीच सीमित सहयोग भी नवाचार को और अधिक सीमित कर देता है तथा उच्च-मूल्य, पेटेंटेड दवाओं के विकास की गति को धीमा कर देता है।
- उभरती एवं तकनीकी चुनौतियाँ: उद्योग को रोगाणुरोधी प्रतिरोध (AMR) जैसे नए मुद्दों का भी सामना करना पड़ रहा है, जो एंटीबायोटिक दवाओं के अत्यधिक उपयोग से जुड़ा हुआ है।
- बायोफार्मास्यूटिकल्स, कृत्रिम बुद्धिमत्ता आधारित दवा खोज और हरित विनिर्माण के बढ़ते प्रसार के साथ, उद्योग को तेज़ तकनीकी अनुकूलन की आवश्यकता है।
- कंपनियों को वैश्विक प्रतिस्पर्द्धा बनाए रखने और पर्यावरणीय स्थिरता सुनिश्चित करने के लिये अपने उत्पादन केंद्र तथा विशेषज्ञता को उन्नत करना आवश्यक है।
भारत के फार्मास्यूटिकल क्षेत्र को मज़बूत करने हेतु कौन-से उपाय किये जा सकते हैं?
- GMP अनुपालन को मज़बूत करना: MSME फार्मा इकाइयों की अवसंरचना को सब्सिडी वाले ऋण और प्रौद्योगिकी अनुदान के माध्यम से उन्नत करना।
- अनिवार्य तृतीय-पक्ष ऑडिट और अचानक निरीक्षण ताकि अनुसूची M और WHO-GMP अनुपालन को सख्ती से सुनिश्चित किया जा सके।
- औषधि विनियमन का आधुनिकीकरण: एक एकीकृत, केंद्रीय राष्ट्रीय दवा प्राधिकरण स्थापित करना ताकि अनुमोदन प्रक्रिया को सरल बनाया जा सके और CDSCO तथा राज्य स्तर के अधिकारों में अतिव्यापकता से बचा जा सके।
- लाइसेंसिंग, बैच ट्रैकिंग और दुष्प्रभाव रिपोर्टिंग के लिये समान डिजिटल प्लेटफॉर्म को लागू करना।
- आयातित API पर निर्भरता कम करना: घरेलू API और मध्यवर्ती विनिर्माण को पुनर्जीवित करने हेतु बल्क ड्रग पार्क तथा PLI योजनाओं को तेज़ी से आगे बढ़ाना। महत्त्वपूर्ण API के लिये दीर्घकालिक खरीद गारंटी या व्यवहार्यता-अंतर वित्तपोषण प्रदान करना।
- अनुसंधान, नवाचार और दवा खोज को बढ़ावा देना: फार्मा अनुसंधान एवं विकास में सार्वजनिक निवेश को कम-से-कम 2% GDP तक बढ़ाना, साथ ही स्टार्ट-अप और शैक्षणिक संस्थानों के लिये अनुदान प्रदान करना।
- PRIP योजना के अंतर्गत राष्ट्रीय औषधि शिक्षा एवं अनुसंधान संस्थानों, बायोटेक पार्कों और उत्कृष्टता केंद्रों को मज़बूत बनाना।
- निर्यात प्रतिस्पर्द्धात्मकता में सुधार: प्रशिक्षण और वित्तीय सब्सिडी के माध्यम से USFDA और EU-GMP मानकों को पूरा करने में छोटे निर्यातकों का समर्थन करना।
- अफ्रीका, लैटिन अमेरिका और ASEAN बाज़ारों के साथ विनियामक सामंजस्य समझौतों पर बातचीत करना।
- अपशिष्ट प्रबंधन मानकों को मज़बूत करना: भारत को AMR पर अंकुश लगाने, हरित विनिर्माण और विलायक पुनर्प्राप्ति को बढ़ावा देने तथा स्वच्छ, टिकाऊ उत्पादन के लिये शून्य-तरल-निर्वहन क्लस्टर विकसित करने हेतु फार्मा अपशिष्ट मानदंडों को कड़ा करना चाहिये।
निष्कर्ष:
भारत का औषधि उद्योग इस समय एक निर्णायक दौर से गुज़र रहा है — जहाँ एक ओर उसे सस्ती जेनेरिक दवाओं के लिये विश्वभर में सराहा जाता है, वहीं दूसरी ओर गुणवत्ता, सुरक्षा और नवाचार की कमी को लेकर प्रश्न उठ रहे हैं। “फार्मेसी ऑफ वर्ल्ड” की अपनी पहचान बनाए रखने के लिये भारत को नियामक ढाँचे को सुदृढ़ करना, एपीआई (API) आयात पर निर्भरता घटाना, अनुसंधान एवं डिजिटल नवाचार को प्रोत्साहित करना, और छोटे दवा निर्माताओं को अंतर्राष्ट्रीय मानकों तक पहुँचाने में सहयोग देना होगा।
|
दृष्टि मुख्य परीक्षा प्रश्न: प्रश्न: “संशोधित अनुसूची एम वैश्विक मानक विनिर्माण की दिशा में एक बड़ा कदम है, लेकिन भारत के फार्मा क्षेत्र को गहन संरचनात्मक सुधार की आवश्यकता है।” चर्चा कीजिये |
अक्सर पूछे जाने वाले प्रश्न (FAQ)
1. औषधि एवं प्रसाधन सामग्री अधिनियम के अंतर्गत अनुसूची M क्या है?
यह औषधि एवं प्रसाधन सामग्री अधिनियम के अंतर्गत फार्मा क्षेत्रों के लिये उत्तम विनिर्माण पद्धतियाँ (GMP) और बुनियादी ढाँचे के मानक निर्धारित करती है, इसे WHO-GMP मानदंडों के अनुरूप बनाने के लिये वर्ष 2023 में संशोधित किया गया है।
2. औषधीय क्षेत्र में भारत की वैश्विक स्थिति क्या है?
भारत मात्रा के आधार पर विश्व का तीसरा सबसे बड़ा औषधि उत्पादक है, जो वैश्विक जेनेरिक दवाओं का लगभग 20% और यूनिसेफ को 55–60% टीकों की आपूर्ति करता है।
3. भारतीय औषधि महानियंत्रक (DCGI) कौन है?
DCGI केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO) का प्रमुख है, जो देश भर में गुणवत्तापूर्ण दवाओं की आपूर्ति सुनिश्चित करने के लिये ज़िम्मेदार है।
UPSC सिविल सेवा परीक्षा, विगत वर्ष के प्रश्न
प्रश्न. निम्नलिखित में से कौन-से, भारत में सूक्ष्मजैविक रोगजनकों में बहु-औषध प्रतिरोध के होने के कारण हैं? (2019)
- कुछ व्यक्तियों में आनुवंशिक पूर्ववृत्ति (जेनेटिक प्रीडिस्पोज़ीशन) का होना।
- रोगों के उपचार के लिये वैज्ञानिकों (एंटिबॉयोटिक्स) की गलत खुराकें लेना।
- पशुधन फार्मिंग प्रतिजैविकों का इस्तेमाल करना।
- कुछ व्यक्तियों में चिरकालिक रोगों की बहुलता होना।
नीचे दिये गए कूट का प्रयोग कर सही उत्तर चुनिये:
(a) केवल 1 और 2
(b) केवल 2 और 3
(c) केवल 1, 3 और 4
(d) केवल 2, 3 और 4
उत्तर: (b)
मेन्स:
प्रश्न. भारत सरकार औषधि के पारंपरिक ज्ञान को औषधि कंपनियों द्वारा पेटेंट कराने से कैसे बचा रही है?
(2019)